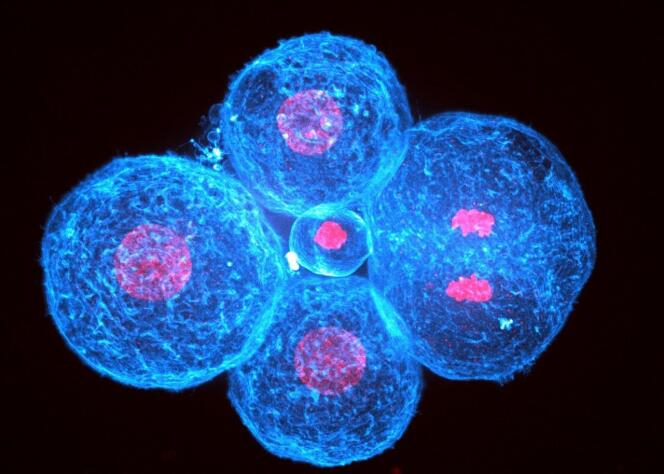
C’est l’un des moments magiques auxquels un biologiste peut assister. Quand un embryon humain de 4 jours, qui compte alors entre huit et seize cellules, prend forme. Autrement dit, lorsque le processus de division cellulaire passe du plan à la 3D. Une équipe emmenée par Jean-Léon Maître (CNRS, Institut Curie) a cherché à comprendre ce qui permettait à ces cellules de s’agglutiner ainsi, pour cette phase dite « de compaction de l’embryon ». Les chercheurs ont découvert que le principal moteur de cette construction vivante est non pas une « colle » qui assurerait l’adhérence entre les cellules, mais leur contraction. En cartographiant les tensions à la surface des cellules, ils ont mesuré qu’elles étaient quatre fois plus élevées à l’extérieur de cette mêlée qu’à l’intérieur. De quoi assurer une cohésion de l’ensemble. Selon leur étude, publiée dans Nature, le 1er mai, les cellules qui sont parfois exclues de l’embryon le sont parce qu’elles ont un défaut de contractilité.
« Ces cellules sont poussées par leurs voisines, comme s’il y avait de la part de l’embryon en bonne santé une capacité à reconnaître des cellules potentiellement dangereuses », explique Jean-Léon Maître, qui a travaillé avec Julie Firmin, première autrice de l’étude, médecin de la reproduction à Port-Royal (AP-HP). Ce sont effectivement les cellules les plus molles qui sont repoussées vers l’extérieur, soit pour être définitivement exclues de l’embryon – et elles mourront –, soit pour les faire migrer vers les tissus extra-embryonnaires qui donneront naissance par exemple au placenta.
Etudier les défaillances de contractilité
Pour cette recherche, l’équipe pluridisciplinaire a travaillé à partir d’embryons congelés ne faisant plus l’objet d’un projet parental et donnés à la science. L’aspiration par micropipettes de verre, celles couramment utilisées dans les centres de procréation médicalement assistée, a ainsi permis de mesurer précisément la tension de la surface d’une cellule dans sa section mitoyenne d’une autre comme dans celle en contact avec le milieu environnant. Ce sont donc des lois de la physique qui permettent de comprendre cette compaction à un stade où les cellules sont indifférenciées.
Pour Jean-Léon Maître, cette compréhension devrait permettre d’orienter les recherches sur l’embryon. Au lieu, par exemple, d’essayer de rechercher les causes d’éventuels défauts d’adhérence des cellules embryonnaires entre elles pour comprendre des problèmes de développement d’un embryon, il faudrait étudier des défaillances de contractilité de ses cellules. Il souligne aussi que cela pourrait servir pour orienter les pratiques en matière de diagnostic préimplantatoire en évitant de cibler les cellules qui risquent d’être exclues de l’embryon. Pour l’heure, ce n’est que la compréhension de la morphogenèse humaine qui s’éclaire un peu plus.




